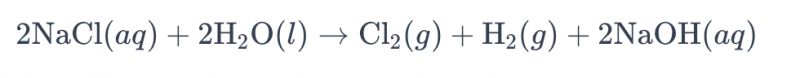Die Elektrolyse einer Salzlösung mit Titanelektroden zur Chlorgewinnung wird gemeinhin als „Salzlösungselektrolyse“ bezeichnet. Dabei werden Titanelektroden eingesetzt, um die Oxidationsreaktion der Chloridionen in der Salzlösung zu beschleunigen, wodurch Chlorgas entsteht. Die Gesamtreaktionsgleichung lautet wie folgt:
In dieser Gleichung werden Chloridionen an der Anode oxidiert, wodurch Chlorgas entsteht, während Wassermoleküle an der Kathode reduziert werden, wodurch Wasserstoffgas gebildet wird. Zusätzlich werden Hydroxidionen an der Anode reduziert, wobei Wasserstoffgas und Natriumhydroxid entstehen.
Die Wahl von Titanelektroden beruht auf der hervorragenden Korrosionsbeständigkeit und Leitfähigkeit von Titan, wodurch die Reaktion während der Elektrolyse stabil und korrosionsfrei ablaufen kann. Dies macht Titanelektroden zur idealen Wahl für die Elektrolyse von Salzlösungen.
Die Elektrolyse von Salzwasser erfordert typischerweise eine externe Stromquelle, um die Energie für die elektrolytische Reaktion bereitzustellen. Diese Stromquelle ist üblicherweise ein Gleichstromnetzteil, da elektrolytische Reaktionen eine konstante Stromrichtung erfordern und ein Gleichstromnetzteil eine konstante Stromrichtung liefern kann.
Bei der Elektrolyse von Salzwasser zur Chlorgaserzeugung wird üblicherweise ein Niederspannungs-Gleichstromnetzteil verwendet. Die Spannung des Netzteils hängt von den spezifischen Reaktionsbedingungen und der Gerätekonstruktion ab, liegt aber im Allgemeinen zwischen 2 und 4 Volt. Darüber hinaus ist die Stromstärke des Netzteils ein entscheidender Parameter, der anhand der Größe der Reaktionskammer und der gewünschten Ausbeute bestimmt werden muss.
Zusammenfassend lässt sich sagen, dass die Wahl der Stromversorgung für die Elektrolyse von Salzwasser von den spezifischen Anforderungen der Experimente oder industriellen Prozesse abhängt, um eine effiziente Reaktion und die Gewinnung der gewünschten Produkte zu gewährleisten.
Veröffentlichungsdatum: 16. Januar 2024